スポットライトリサーチ
天然のナノチューブ「微小管」の中にタンパク質を入れると何が起こる?
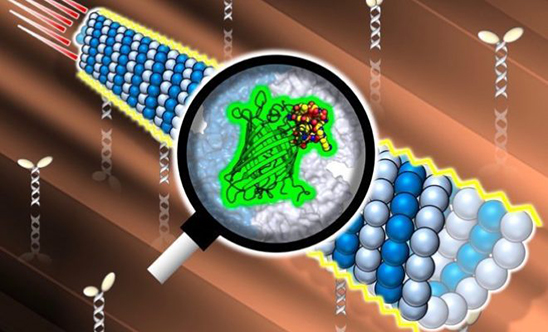
今回のスポットライトリサーチは、鳥取大学大学院 工学研究科・稲葉 央 助教にお願いしました。
稲葉先生の所属する松浦研究室![]() では、人工的に設計したペプチドの自己集合を活用して巨大な構造体を合成し、それをカプセルのように使うという研究にチャレンジしています(紹介漫画①
では、人工的に設計したペプチドの自己集合を活用して巨大な構造体を合成し、それをカプセルのように使うという研究にチャレンジしています(紹介漫画①![]() ②
②![]() が分かりやすいので、ぜひご覧下さい!)。今回紹介する内容はこれまで培ったペプチド構造学の知見を生かし、自然界が生み出したさらに巨大な構造体「微小管
が分かりやすいので、ぜひご覧下さい!)。今回紹介する内容はこれまで培ったペプチド構造学の知見を生かし、自然界が生み出したさらに巨大な構造体「微小管![]() 」をナノチューブとして捉え、その中に好きなものを入れられないか?との考えから取り組まれた成果です。本成果はChem. Commun.誌原著論文として公開され、プレスリリース
」をナノチューブとして捉え、その中に好きなものを入れられないか?との考えから取り組まれた成果です。本成果はChem. Commun.誌原著論文として公開され、プレスリリース![]() 、Chem. Commun. Front Cover(アイキャッチ画像)
、Chem. Commun. Front Cover(アイキャッチ画像)![]() として取り上げられています。
として取り上げられています。
“
“Stabilization of microtubules by encapsulation of the GFP using a Tau-derived peptide”
Inaba, H.*; Yamamoto, T.; Iwasaki, T.; Kabir, A. M. R.; Kakugo, A.; Sada, K.; Matsuura, K.* Chem. Commun. 2019, 55, 9072-9075. doi:10.1039/C9CC04345D![]()
”
研究室を主宰されています松浦和則 教授から、稲葉先生について以下の人物評を頂いております。
“
稲葉君は、どんな学生に対しても面倒見の良い研究指導をしており、学生からの評判も高い助教です。微小管の研究は、私の「微小管の中に何か入れたい」という無茶振りにより、何もわからない状況からスタートした研究ですが、稲葉君が独自に調査・検討して微小管内包ペプチドの創製に成功しました。研究に対する調査能力・洞察力が高く、将来の生体機能関連化学分野をリードする若手研究者として注目される人材だと思います。
”
それでは今回も、現場からのコメントをお楽しみ下さい!
Q1. 今回プレスリリースとなったのはどんな研究ですか?簡単にご説明ください。
我々が開発したペプチドを用いることで、タンパク質ナノチューブ「微小管」の中に緑色蛍光タンパク質GFPを入れることに成功しました。微小管は私たちの細胞内にも存在するナノチューブで、内径15 nm程度の「穴」を持っています。微小管は抗がん剤の標的やデバイス応用など多くの分野で注目を集めていますが、この穴はほとんど着目されてきませんでした。今回我々は、微小管内壁に結合するTau由来ペプチドTP[1]をGFPに連結することで、微小管内部へのGFPの導入にはじめて成功しました。面白いことに、TPを連結したGFP(TP-GFP)を内包した微小管は通常の微小管に比べて長く剛直で、モータータンパク質を固定した基板における運動速度が増加することが明らかとなりました。微小管の形成の促進、解離の阻害も見られ、GFPが裏打ちのような形で結合して微小管を安定化していると考えられます。本研究は微小管の「中」を理解して応用する第一歩となります。
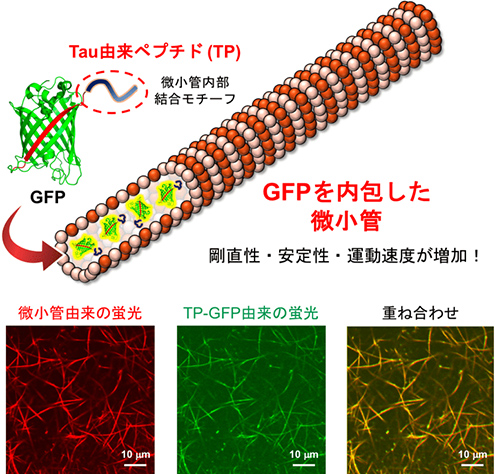
図1:Tau由来ペプチド(TP)を用いた微小管へのGFP内包とその蛍光像
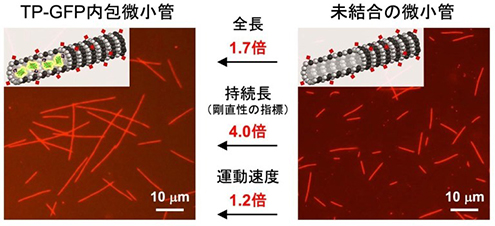
図2:TP-GFP内包微小管の物性
Q2. 本研究テーマについて、自分なりに工夫したところ、思い入れがあるところを教えてください。
正直なところ、この研究の基となった微小管内壁に結合するペプチドの開発の方が大変で、工夫が必要でした [1]。着任後、微小管について何もわからない0からのスタートで、そもそも微小管がうまくできないという初歩的なところから始めたのを覚えています。微小管内部への結合をどうやって調べるかも含め、当時の四年生と試行錯誤を繰り返していました。今回の研究は、「微小管の中に結合するペプチドが見つかったし、同じ方法でタンパク質でも入れてみよう」という単純な発想で始まりました。その時点ではGFPの内包により微小管が安定化することを予期していた訳ではなく、結果的に面白い現象が見つかった、という「驚き」をくれた点で愛着があります。
Q3. 研究テーマの難しかったところはどこですか?またそれをどのように乗り越えましたか?
前述した先行研究で内包の方法については詳しく調べていたので、内包の実験自体はそれほど問題ありませんでした。ただ、GFPが微小管に結合しているかどうかは蛍光顕微鏡ですぐにわかりますが、実際に微小管の「中」に導入されているかどうかを確かめるのには苦労しました。色々な方法を試した結果、最終的には「抗GFP抗体が結合できない位置、すなわち微小管の内部にGFPは結合している」という間接的な方法で微小管への内包を示しています。このあたりはまだ改善の余地があると考えています。
Q4. 将来は化学とどう関わっていきたいですか?
私の研究のベースにあるのは「生体分子で面白いものを作りたい」というシンプルな考えです。生物はペプチドやタンパク質などの生体分子を用いて緻密な化学を展開しています。これら天然のお手本から学び、化学の力で手を加えて「いじる」ことで面白いものづくりをしていきたいと考えています[2]。本研究で用いたペプチドでいえば、最近細胞内の微小管にも結合することがわかってきました [3] 。将来的に細胞内の微小管を好き勝手にいじって細胞自体の性質を変えることができるかもしれません。自分が設計した通り分子が動いてくれるのももちろん魅力的ですが、今回の研究のような予期せぬ発見も楽しみにして(見逃さずよう)研究を進めていきたいと思います。
Q5. 最後に、読者の皆さんにメッセージをお願いします。
私は期せずして研究場所やテーマを変えてきましたが、周りの人に比べて思うように成果が出せずに苦しんだ経験があります(今もですが、、)。それでもなんとかやってこられたのは、周りのサポートはもちろんですが、これまで世界になかった研究をしているという自分なりの自負(のようなもの)があったからです。他人は他人として、自分のテーマに責任とこだわりを持ってやっていればいつかいい目を見ることもある、と信じることが大事かと思います(自分にも言い聞かせています)。
最後に、日頃からご指導いただいている松浦教授、いつも共同研究でお世話になっている北海道大学のKabir特任助教、角五准教授、佐田教授、鳥取大学農学部の岩崎准教授に改めて感謝申し上げます。
参考文献
- H. Inaba, T. Yamamoto, A. M. R. Kabir, A. Kakugo, K. Sada, K. Matsuura, Chem. Eur. J. 2018, 24, 14958.
- H. Inaba, K. Matsuura, Chem. Rec. 2019, 19, 843.
- H. Inaba, T. Yamamoto, T. Iwasaki, A. M. R. Kabir, A. Kakugo, K. Sada, K. Matsuura, ACS Omega 2019, 4, 11245.
研究者の略歴

【名前】稲葉 央(いなば ひろし)
【所属】鳥取大学 学術研究院工学系部門 助教
【研究テーマ】ペプチドを基軸とした微小管内部空間の機能開拓
【略歴】
2011.3 名古屋大学 大学院理学研究科 物質理学専攻 博士前期課程修了(渡辺芳人研究室)
2014.9 京都大学 大学院工学研究科 合成・生物化学専攻 博士後期課程単位取得退学(北川進研究室)JSPS特別研究員(DC2)
2015.1 博士(工学)
2015.1–2016.2 イリノイ大学アーバナ・シャンペーン校化学科 博士研究員(Jefferson Chan![]() 研究室)
研究室)
2016.3–現在 鳥取大学 大学院工学研究科 化学・生物応用工学専攻 助教(松浦和則研究室)