新型コロナウイルス感染症で注目が高まった、ワクチンや治療薬を
はじめとする新薬の開発。病に苦しむ人々に一刻も早く届けようと世界の
製薬企業でさまざまな研究が進められています。多くの医薬品は効果と
同様に副作用を持っているため、高い安全性が求められます。
そのため、日本では「医薬品、医療機器等の品質、有効性及び安全性の
確保等に関する法律」(薬機法)によって、開発から使用までの過程で厳しく
管理されています。今回は、新薬の開発の流れを踏まえながら、
「新薬の販売承認」とはどのようなものなのか見ていきましょう。
Reading keywords
「新薬の販売承認」とは?
新薬は長い年月をかけ、創られ育てられる。
成功する確率は0.0044%!?
厳しいチェックをクリアして新薬は誕生する
私たちの健康を支えている医薬品。長い歴史の中で、新薬の開発はそれまで不治だった病気や感染症を克服する希望を多くの人に与えてきました。定期的に新薬のニュースが報じられますが、世界中で接種が進んだ新型コロナウイルスのワクチンもその一つです。最近では日本の製薬企業が開発したアルツハイマー病の新薬がアメリカで一足先に承認され、日本でも承認申請が行われたことが話題になりました。今回は新薬が開発され、人々の手元に届くまでの仕組みを探ります。
医薬品の開発には、10年以上の時間と数百億円から数千億円規模の費用が必要とされ、難易度も高く、成功する確率は約22,700分の1(0.0044%)※ともいわれています。こうした中、世界中の製薬企業が努力を重ねていますが、日本はアメリカ、スイスに継ぐ世界第3位※の新薬開発力を持ち、世界に貢献しています。
現在、国内で使用されている医薬品は、大きく3つに分けられます。
(1)医療用医薬品:医師の処方に基づいて使用する
・新医薬品:「新薬」と呼ばれるもの
・後発医薬品:「新薬」と同等の効果・効能を持つもの
(2)要指導医薬品:薬剤師の指導に基づいて使用する
(3)一般用医薬品:薬局で購入して使用する
特許が認められる20年間は、開発した製薬企業が独占的に新薬を供給できますが、特許が切れた後は情報が公開され、他社も製造・販売ができるようになります。これを後発医薬品(ジェネリック医薬品)と呼びます。
新薬は、製薬企業が品質・有効性・安全性を確認した上で、厚生労働大臣に製造販売承認申請を行い、審査をパスしなくてはなりません。新薬が私たちの手に届くまでには、開発、承認、製造、流通、使用の段階がありますが、薬機法に基づいて、すべての段階で厳しい管理基準が設けられています。また、製薬業界では自主規制を設け、より高水準での品質管理が行われています。こうした管理によって、私たちは品質のよい医薬品を安心して使うことができるのです。
※【出典】厚生労働省「医薬品産業ビジョン2021 資料編」
知っておきたい新薬開発の流れ
新薬のゴールは販売ではない?
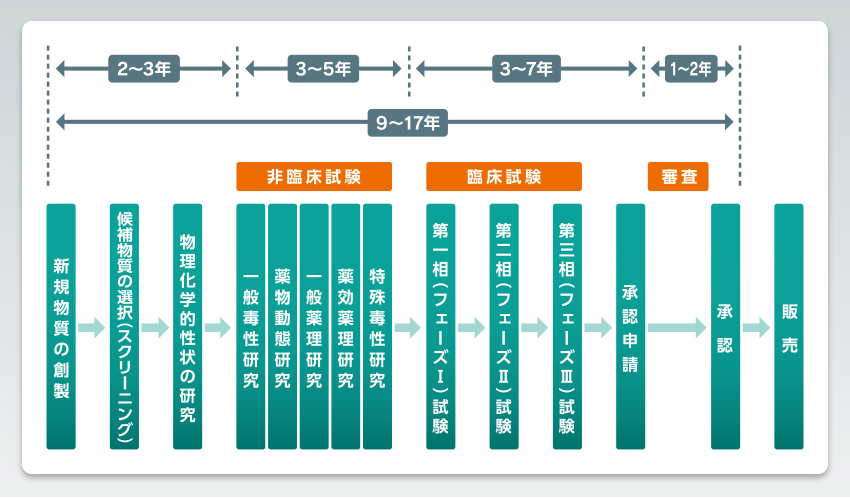
ここでは新薬の開発から承認までの流れを見てみましょう。大きく分けると、下記の4つのプロセスがあります。
- 基礎研究:
新薬の可能性を持つ物質や、有効成分を化学的につくり出す方法を探求する - 非臨床試験:
動物や培養細胞を用いた試験で、有効性と安全性を確認する - 臨床試験(治験):
人間にも安全で効果があるかを確認する - 承認申請と審査:
厚生労働省に承認申請を行う。独立行政法人の医薬品医療機器総合機構(PMDA)が有効性と安全性を審査する
長い年月をかけて基礎研究から治験まで終了すると、新薬の承認申請が行われます。通常、新薬の審査と承認には1~2年ほどかかるとされています。
承認申請資料の審査は、医学、薬学、生物統計学などの分野別の専門家が行い、さらに外部専門家などの意見を踏まえて審査報告書が作成されます。申請が厚生労働大臣によって承認されると、製薬企業は新薬を販売できるようになります。データの蓄積が少ない新薬の品質・有効性・安全性の承認においては、特に慎重な検討を行う仕組みが取られています。なお、2021年に日本で承認された新医薬品は135品目で、審査期間の中央値は9.9カ月でした。
こうして世の中に出る新薬ですが、新薬は販売がゴールではありません。販売後に収集された国内外の情報により、有効性・安全性の再審査を受けるよう義務付けられています。収集した情報をもとに、新薬はよりよいものへと成長していきます。新薬を開発する「創薬」に対して、発売後の情報収集と改善は「育薬」といいます。育薬では患者が飲みやすい剤形に変更したり、創薬段階では分からなかった薬の作用や使い方などの情報が共有されたりすることで、より安全で使いやすい薬へと改良され、次の新薬の開発などに生かされていくのです。
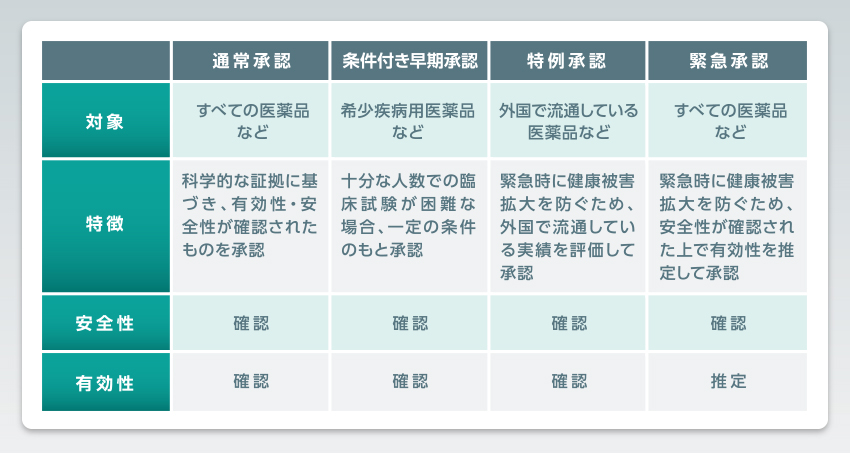
パンデミックなどの緊急時の措置として、通常承認のほかに条件付き早期承認、特例承認、緊急承認といった制度が設けられています。コロナ禍ではワクチンや経口薬が特例承認や緊急承認されました。
まだ見ぬ新薬の開発へ
新たな未来を切り開く
新薬は人類を多くの病から救ってきましたが、治療薬のない病気はまだ数多く存在しています。患者数が増加の一途をたどるがんやアルツハイマー病は、世界中から治療薬が求められている疾患といえるでしょう。
次世代の医薬品として注目を集めているものの一つは「核酸医薬」です。遺伝情報を担うDNAやタンパク質を合成するRNAといった核酸を利用した医薬品のことで、遺伝子に直接働きかけたり、病気の原因物質に結合して働きを抑えたりと、これまで治療が難しかったがんや遺伝に基づく難病などへの応用が期待されています。
世界で多くの人が接種した新型コロナウイルスのワクチン(mRNAワクチン)も、この核酸医薬の一つでした。新薬となる物質を探し出すのではなく、RNAに着目するアプローチは創薬の大きな可能性を秘めているといえるでしょう。
新薬が誕生する背景には、有効性と安全性を担保する多くの管理基準があります。それらをすべてクリアし、私たちに健康と安心をもたらす創薬事業は、地球の明るい未来を創る大きな責任を担っています。
「新薬の販売承認」に関する富士フイルムのサービス
-
- CTD/eCTD新薬承認申請資料作成支援サービス
- 「新薬申請サービス」は、医薬品の製造販売承認申請から取得までに必要な資料作成をワンストップで支援するアウトソーシングサービスです。
- CTD/eCTD新薬承認申請資料作成支援サービス
記事公開:2023年2月
情報は公開時点のものです

